这篇文档主要讲了中国创新药“出海”过程中,从研发到上市各个阶段在工艺开发与生产(CMC)方面的要点和策略。具体内容如下:
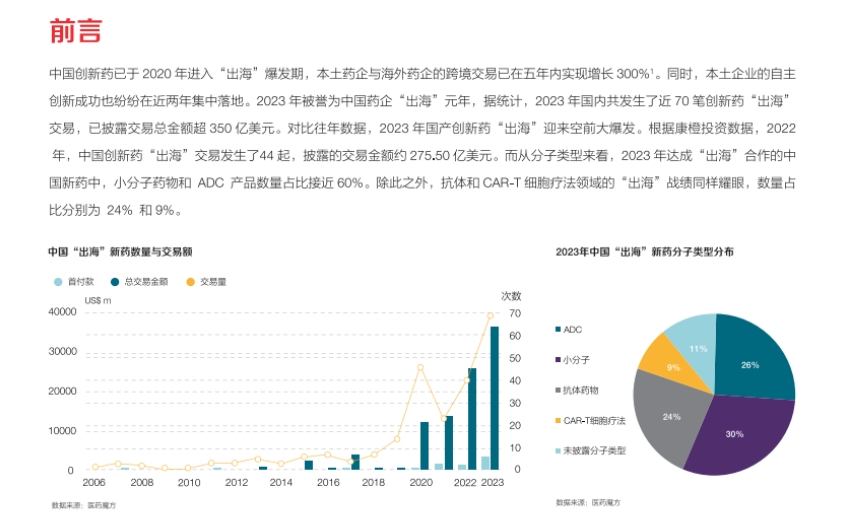
1. 中国创新药“出海”现状:2020年起中国创新药进入“出海”爆发期,2023年尤为突出,交易数量和金额大幅增长,小分子药物、ADC产品、抗体和CAR - T细胞疗法等是主要“出海”的分子类型。中国药企选择“出海”,是因为国内市场规模有限,“出海”能接触更多患者、多样化监管框架、人才技术资源,还能多元化收入、降低市场风险。
2. 新药开发到上市各阶段的CMC策略
- 临床前研究阶段:要确定CMC策略、药代动力学等,其中细胞株开发和制剂开发很关键。细胞株开发可采用靶向整合技术、高通量系统;制剂开发要基于平台工艺经验,确定最优pH等,借助创新分析方法。
- IND申报阶段:提交新药临床研究申请时,要树立全球观念,编写中立的CMC申报资料,全面评估不同管辖区要求的差距。还要建立完善的首次人体试验(FIH)资料,加速早期制剂选择,比如优先考虑西林瓶、冻干制剂等。
- 临床研究阶段:临床研究阶段的CMC研发周期长且不确定,需要提前规划。临床I - II期要合理评估生产需求,前瞻性思考生产能力,明确制剂选择和剂量,采用灵活生产方式;临床III期则要提前制定工艺放大计划和技术转移策略。
- 商业化规模生产阶段:商业化生产阶段,分析方法验证、工艺表征与工艺验证很重要。分析方法验证前要评估稳健性,工艺表征要借助缩小模型、实验设计等方法,工艺验证需确定批次数量,最终提交法规监管审批。
3. 特定市场的新药上市考量:不同国家和地区对药品上市有特殊要求,如欧盟要明确质量授权人职责;美国要注意356h申请表、企业注册列名;英国脱欧后需单独申请上市许可、进行批检验;中国有关联审评,对原液、辅料、验证批次等有具体要求。
4. 总结与建议:创新药出海企业在立项阶段要有全球视野,建立全球人才体系和研发、生产及营销体系。初创企业可借助专业第三方机构。赛默飞Patheon™能为客户提供制药服务解决方案。